Экспресс-методы определения фосфорных соединений в электролите химического никелирования
Вопрос.
Добрый день, уважаемые профессоры! Подскажите, пожалуйста, экспресс-методы определения фосфорных соединений в электролите химического никелирования
С уважением, инженер-технолог Ирина Сергеевна
Ответ.
Ускоренный анализ содержания гипофосфита и фосфита в растворе химического никелирования можно проводить по следующей методике.
Для анализа берут 2 – 5 мл раствора химического никелирования, разбавляют водой до объема 10 мл, прибавляют 10 мл концентрированной соляной кислоты и 0,5 – 1 г хлорида меди СuCl2×2H2O. Раствор перемешивают и вводят электродную пару Pt – C, подключенную к высокоомному вольтметру (блоку высокоомного вольтметра потенциостата или рН-метру в режиме «mV»). Взамен потенциометрического фиксирования точки эквивалентности можно использовать индикаторный метод – в этом случае добавляют одну каплю 0,025М раствора ферроина. Спустя 2 – 3 мин образовавшееся эквивалентное гипофосфиту количество меди (I) при непрерывном перемешивании магнитной мешалкой сразу титруют 0,1 н. раствором дихромата калия. Конечную точку устанавливают по первому максимальному скачку потенциала или по резкому переходу красновато-зеленого цвета в чисто-зеленый от очередной капли титранта (первое титрование).
Затем, если это необходимо, приступают к определению фосфитов. Электроды вынимают и промывают, прибавляют 0,5 – 1 г железоаммонийных квасцов NH4Fe(SO4)2×12H2O и оттитрованный раствор кипятят 3 – 5 мин. Затем опять вводят электроды и титруют образовавшееся эквивалентное фосфиту количество железа (II) 0,1 н. раствором того же окислителя. При титровании с индикатором раствор после кипячения сильно охлаждают, вводят новую каплю 0,025 М раствора ферроина и титруют до изменения цвета раствора (второе титрование).
Содержание гипофосфита NaH2PO2×H2O и фосфита Na2HPO3×5H2O в анализируемой пробе раствора химического никелирования вычисляют по формулам:
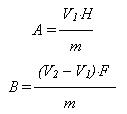
где А – содержание гипофосфита, г/л; В – содержание фосфита, г/л; V1 – объем 0,1 н. раствора дихромата калия, израсходованный на первое титрование, мл; V2 – объем 0,1 н. раствора дихромата калия, израсходованный на второе титрование, мл; Н – титр 0,1 н. раствора дихромата калия по гипофосфиту (теоретический титр по гипофосфиту натрия равен 5,3), мг/мл; F – титр 0,1 н. раствора дихромата калия по фосфиту (теоретический титр по фосфиту натрия равен 5,2), мг/мл.
Ошибка определения гипофосфита и фосфита по этой методике не превышает ±0,4 г/л.
Определение гипофосфита и фосфита можно проводить также иодометрическим методом. При этом фосфит окисляют в щелочной среде (первое титрование), а сумму гипофосфита и фосфита - в кислой среде (второе титрование), по первому титрованию определяют содержание фосфита натрия, а по разности второго и первого титрований – содержание гипофосфита натрия.
Для определения фосфита (первое титрование) берут 25 мл раствора химического никелирования, разбавляют до 200 мл водой в мерной колбе. Из полученного раствора отбирают аликвоту 20 мл (2,5 мл исходного раствора) в коническую колбу емкостью 250 мл. Вводят 20 мл 5% раствора гидрокарбоната натрия NaHCO3, охлаждают раствор, прибавляют 30 мл 0,1 н. раствора иода I2 (для приготовления 1 л такого раствора в 100 мл воды растворяют 40 г иодида калия KI, затем растворяют 12,7 г иода I2 и доводят до 1 л дистиллированной водой), закрывают колбу и оставляют в темном месте на 2 ч. Затем в раствор добавляют 20 мл 10% раствора уксусной кислоты CH3COOH и титруют избыток иода 0,1 н. раствором тиосульфата натрия Na2S2O3×5H2O в присутствии крахмала до исчезновения синей окраски раствора.
Содержание Na2HPO3×5H2O (г/л) рассчитывают по формуле:
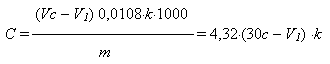
где V – объем 0,1 н раствора иода, введенный в пробу, мл (30 мл); V1 – объем 0,1 н. раствора тиосульфата натрия, израсходованный на титрование, мл; с – соотношение концентраций растворов тиосульфата и иода; 0,0108 – теоретический титр 0,1 н. раствора тиосульфата натрия по фосфиту натрия, г/мл; k – коэффициент нормальности 0,1 н. раствора тиосульфата натрия; m – объем электролита, взятый для анализа, мл (в данном случае 2,5 мл).
Для определения гипофосфита (второе титрование) берут 25 мл раствора химического никелирования, разбавляют до 200 мл водой в мерной колбе. Из полученного раствора отбирают аликвоту 20 мл (2,5 мл исходного раствора) в коническую колбу емкостью 250 мл, добавляют 30 мл 0,1 н. раствора иода I2 (приготовление описано выше), 10 мл 10% раствора серной кислоты H2SO4, закрывают колбу и оставляют в темном месте на 6 ч. Затем раствор подщелачивают пастой гидрокарбоната натрия NaHCO3, добавляют 20 мл 5% раствора гидрокарбоната натрия NaHCO3, закрывают колбу и оставляют на 2 ч. В раствор добавляют 20 мл 10% раствора уксусной кислоты CH3COOH и титруют избыток иода 0,1 н. раствором тиосульфата натрия Na2S2O3×5H2O в присутствии крахмала до исчезновения синей окраски раствора.
Содержание NaH2PO2×H2O (г/л) рассчитывают по формуле:
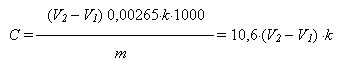
где V2 – объем 0,1 н раствора тиосульфата, израсходованный на второе титрование, мл; V1 – объем 0,1 н. раствора тиосульфата натрия, израсходованный на первое титрование, мл; 0,00265 – теоретический титр 0,1 н. раствора тиосульфата натрия по гипофосфиту натрия, г/мл; k – коэффициент нормальности 0,1 н. раствора тиосульфата натрия; m – объем электролита, взятый для анализа, мл (в данном случае 2,5 мл).
23.01.2009




